| Alfa-amilaza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
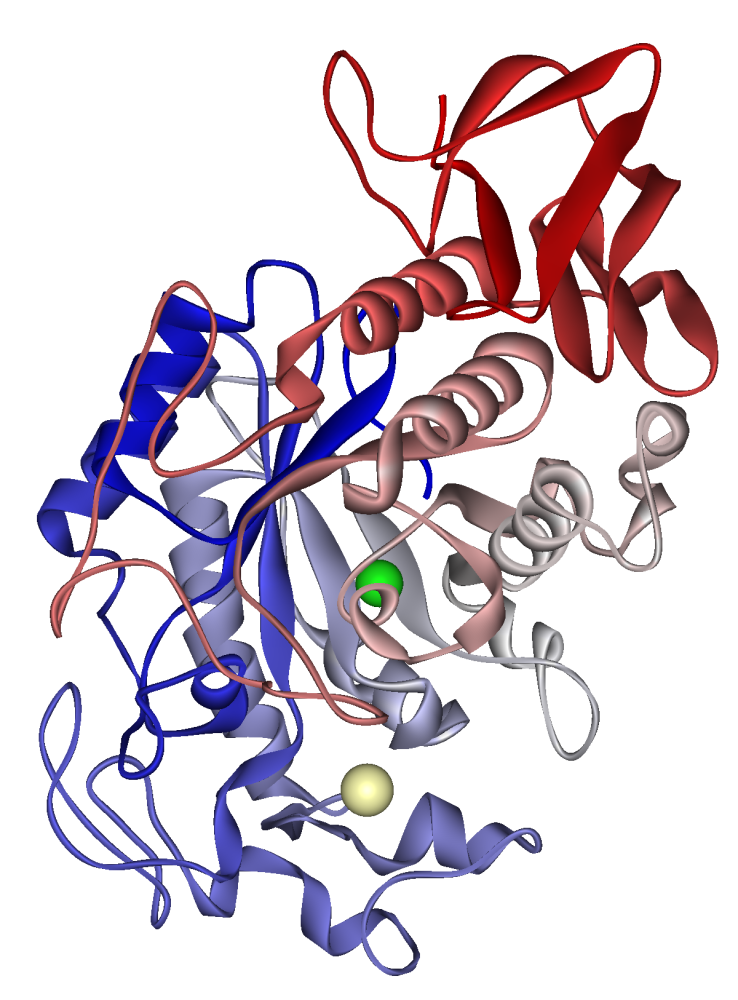
Amilaza salivară umană: ion calciu vizibil în kaki pal, ion clorură în verde. PDB 1SMD
|
|||||||||
| Identificatori | |||||||||
| CE nr. | 3.2.1.0 | ||||||||
| CAS nr. | 9000-90-2 | ||||||||
| Baze de date | |||||||||
| IntEnz | Vizualizare IntEnz | ||||||||
| BRENDA | Intrare BRENDA | ||||||||
| EXPASy | Vedere NiceZyme | ||||||||
| KEGG | Intrare KEGG | ||||||||
| MetaCyc | cale metabolică | ||||||||
| PRIAM | profil | ||||||||
| Structuri PDB | RCSB PDB PDBe PDBsum | ||||||||
|
|||||||||
| Domeniul catalitic GH13 | |||||||||
|---|---|---|---|---|---|---|---|---|---|

Ciclodextrină glucanotransferază (ec2.4.1.19) (cgtază)
|
|||||||||
| Identificatori | |||||||||
| Simbol | Alfa-amilaza | ||||||||
| Pfam | PF00128 | ||||||||
| Clanul Pfam | CL0058 | ||||||||
| InterPro | IPR006047 | ||||||||
| SCOP2 | 1ppi / SCOPe / SUPFAM | ||||||||
| Superfamilia OPM | 117 | ||||||||
| Proteina OPM | 1wza | ||||||||
| CAZY | GH13 | ||||||||
| CDD | cd11338 | ||||||||
|
|||||||||
| Domeniu beta-sheet alfa-amilază C-terminal | |||||||||
|---|---|---|---|---|---|---|---|---|---|

Structura cristalină a orzo alfa-amilazei izozima 1 (amy1) mutant inactiv d180a în complex cu maltoheptaoză
|
|||||||||
| Identificatori | |||||||||
| Simbol | Alfa-amil_C2 | ||||||||
| Pfam | PF07821 | ||||||||
| InterPro | IPR012850 | ||||||||
|
|||||||||
| Alfa amilază, domeniu C-terminal all-beta | |||||||||
|---|---|---|---|---|---|---|---|---|---|
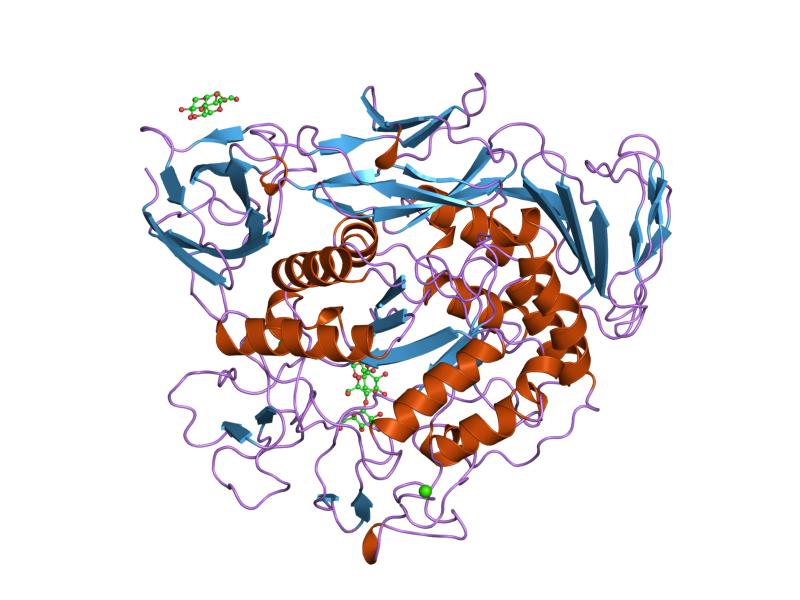
complex maltotriozic al ciclantului precondiționat glicoziltransferază mutant
|
|||||||||
| Identificatori | |||||||||
| Simbol | Alfa-amilază_C | ||||||||
| Pfam | PF02806 | ||||||||
| Clanul Pfam | CL0369 | ||||||||
| InterPro | IPR006048 | ||||||||
| SCOP2 | 1ppi / SCOPe / SUPFAM | ||||||||
|
|||||||||
Alfa-amilaza, (α-amilază) este o enzimă EC 3.2.1.1 care hidrolizează legăturile alfa ale polizaharidelor mari, legate cu alfa, cum ar fi amidonul și glicogenul, producând lanțuri mai scurte ale acestora, dextrine și maltoză. Este principala formă de amilază găsită la om și la alte mamifere. Este, de asemenea, prezent în semințele care conțin amidon ca rezervă alimentară și este secretat de multe ciuperci. Este un membru al familiei glicozidhidrolazei 13.
În biologia umană
Deși se găsește în multe țesuturi, amilaza este cea mai proeminentă în sucul pancreatic și în salivă, fiecare dintre acestea având propria izoformă a α-amilazei umane. Se comportă diferit în ceea ce privește focalizarea izoelectrică și pot fi, de asemenea, separate în testare utilizând anticorpi monoclonali specifici. La om, toate izoformele amilazei se leagă de cromozomul 1p21 (vezi AMY1A).
Amilază salivară (ptialină)
Amilaza se găsește în salivă și rupe amidonul în maltoză și dextrină. Această formă de amilază mai este numită „ptialină” /ˈtaɪəlɪn/, care a fost numit de chimistul suedez Jöns Jacob Berzelius. Numele derivă din cuvântul grecesc πτυω (scuip), deoarece substanța a fost obținută din salivă. Acesta va sparge molecule mari de amidon insolubile în amidon solubile (amilodextrină, eritrodextrină și achrodextrină) producând amidonuri mai mici succesiv și în cele din urmă maltoză. Ptyalina acționează asupra legăturilor glicozidice liniare α (1,4), dar hidroliza compusă necesită o enzimă care acționează asupra produselor ramificate. Amilaza salivară este inactivată în stomac de acidul gastric. În sucul gastric ajustat la pH 3,3, ptialina a fost total inactivată în 20 de minute la 37 ° C. În schimb, 50% din activitatea amilazei a rămas după 150 de minute de expunere la suc gastric la pH 4,3. Atât amidonul, substratul ptyalinei, cât și produsul (lanțuri scurte de glucoză) sunt capabile să îl protejeze parțial împotriva inactivării de acid gastric. Ptialina adăugată la tampon la pH 3,0 a suferit o inactivare completă în 120 de minute; cu toate acestea, adăugarea de amidon la un nivel de 0,1% a dus la 10% din activitatea rămasă și o adăugare similară de amidon la un nivel de 1,0% a dus la aproximativ 40% din activitate rămânând la 120 de minute.
Condiții optime pentru ptialină
- PH optim – 7,0
- Temperatura corpului uman
- Prezența anumitor anioni și activatori:
- Clorura și bromura – cele mai eficiente
- Iodură – mai puțin eficientă
- Sulfat și fosfat – cel mai puțin eficace
Variația genetică a amilazei salivare umane
Gena amilazei salivare a suferit duplicări în timpul evoluției, iar studiile de hibridizare a ADN-ului indică faptul că mulți indivizi au repetări multiple ale genei în tandem. Numărul de copii ale genelor se corelează cu nivelurile de amilază salivară, măsurată prin teste de proteină blot folosind anticorpi împotriva amilazei umane. Numărul de copii genetice este asociat cu o expunere evolutivă aparentă la dietele bogate în amidon. De exemplu, o persoană japoneză avea 14 copii ale genei amilazei (o alelă cu 10 copii și o a doua alelă cu patru copii). Dieta japoneză conține în mod tradițional cantități mari de amidon de orez. În schimb, un individ Biaka purta șase exemplare (trei exemplare pe fiecare alelă). Biaka sunt vânători-culegători de păduri tropicale care au consumat în mod tradițional o dietă cu conținut scăzut de amidon. Perry și colegii săi au speculat că numărul crescut de copii ale genei salivare a amilazei ar putea avea o supraviețuire sporită, coincidentă cu trecerea la o dietă cu amidon în timpul evoluției umane.
Amilaza pancreatică
A-amilaza pancreatică clivează aleator legăturile α (1-4) glicozidice ale amilozei pentru a produce dextrină, maltoză sau maltotrioză. Adoptă un mecanism cu dublă deplasare cu păstrarea configurației anomerice. La om, amilaza salivară a evoluat dintr-o copie a acesteia.
În patologie
Testul pentru amilază este mai ușor de realizat decât cel pentru lipază, făcându-l testul principal utilizat pentru detectarea și monitorizarea pancreatitei. Laboratoarele medicale vor măsura de obicei fie amilaza pancreatică, fie amilaza totală. Dacă se măsoară numai amilaza pancreatică, nu se va observa o creștere la oreion sau la alte traume ale glandei salivare.
Cu toate acestea, din cauza cantității mici prezente, sincronizarea este esențială la prelevarea de sânge pentru această măsurare. Sângele trebuie administrat la scurt timp după o durere de pancreatită, altfel este excretat rapid de rinichi.
A-amilaza salivară a fost utilizată ca biomarker pentru stres și ca marker surogat al activității sistemului nervos simpatic (SNS) care nu necesită extragere de sânge.
Interpretare
Creșterea nivelului plasmatic la om se găsește în:
- Traumatisme salivare (inclusiv intubația anestezică)
- Oreion – datorită inflamației glandelor salivare
- Pancreatita – din cauza deteriorării celulelor care produc amilază
- Insuficiență renală – datorită excreției reduse
Valorile totale ale amilazei de peste 10 ori limita superioară a normalului (LSN) sunt sugestive pentru pancreatită. De cinci până la 10 ori LSN poate indica boală ileusă sau duodenală sau insuficiență renală, iar creșteri mai mici se întâlnesc frecvent în boala glandei salivare.
Genele
- salivar – AMY1A, AMY1B, AMY1C
- pancreatic – AMY2A, AMY2B
În cereale
Activitatea α-amilazei din cereale se măsoară, de exemplu, cu numărul Hagberg – Perten Falling Number, un test pentru a evalua daunele la germeni sau prin metoda Phadebas. Apare în grâu.
Utilizare industrială
α-Amilaza este utilizată în producția de etanol pentru a sparge amidonul din boabe în zaharuri fermentabile.
Primul pas în producția de sirop de porumb bogat în fructoză este tratamentul amidonului de porumb cu α-amilază, producând lanțuri mai scurte de zaharuri oligozaharide.
O α-amilază numită „Termamil”, provenită din Bacillus licheniformis, este, de asemenea, utilizat în unele detergenți, în special detergenți pentru spălat vase și amidon.
A se vedea amilaza pentru mai multe utilizări ale familiei amilazelor în general.
Potențial pentru uz medical
α-Amilaza a prezentat eficacitate în degradarea biofilmelor bacteriene polimicrobiene prin hidrolizarea legăturilor glicozidice α (1-4) în cadrul exopolizaharidelor structurale, matrice ale substanței polimerice extracelulare (EPS).
Inhibarea tamponului
Se raportează că molecula tris inhibă un număr de α-amilaze bacteriene, deci nu ar trebui utilizate în tamponul tris.
Determinare
Sunt disponibile mai multe metode pentru determinarea activității α-amilazei și diferite industrii tind să se bazeze pe metode diferite. Testul de iod de amidon, o dezvoltare a testului de iod, se bazează pe schimbarea culorii, deoarece α-amilaza degradează amidonul și este frecvent utilizată în multe aplicații. Un test similar, dar produs industrial, este testul amilazei Phadebas, care este utilizat ca test calitativ și cantitativ în multe industrii, cum ar fi detergenți, diverse alimente pentru făină, cereale și malț și biologie criminalistică.
Arhitectura domeniului
α-Amilazele conțin o serie de domenii proteice distincte. Domeniul catalitic are o structură constând dintr-un butoi alfa / beta cu opt catene care conține situsul activ, întrerupt de un domeniu de legare a calciului de ~ 70-aminoacizi care iese între beta catena 3 și alfa helix 3 și un carboxil-terminal grecesc. domeniu cheie beta-baril. Mai multe alfa-amilaze conțin un domeniu beta-sheet, de obicei la capătul C terminal. Acest domeniu este organizat ca o foaie beta antiparalelă cu cinci fire. Mai multe alfa-amilaze conțin un domeniu complet beta, de obicei la capătul C terminal.
.













Discussion about this post