Glucagonul este un hormon peptidic, produs de celulele alfa ale pancreasului. Glucagonul crește concentrația de glucoză și acizi grași din sânge și este considerat a fi principalul hormon catabolic al corpului. Glucagonul este, de asemenea, utilizat ca medicament pentru a trata o serie de afecțiuni de sănătate. Efectul glucagonului este opus celui al insulinei, care scade glucoza extracelulară. Glucagonul este produs din proglucagon, codificat de gena GCG.
Pancreasul eliberează glucagon atunci când cantitatea de glucoză din sânge este prea mică. Glucagonul determină ficatul să se angajeze în glicogenoliză: transformând glicogenul stocat în glucoză, care este eliberată în sânge. Nivelurile ridicate de glucoză din sânge, pe de altă parte, stimulează eliberarea de insulină. Insulina permite preluarea și utilizarea glucozei de către țesuturile insulino-dependente. Astfel, glucagonul și insulina fac parte dintr-un sistem de feedback care menține stabil nivelul glicemiei. Glucagonul crește consumul de energie și este crescut în condiții de stres. Glucagonul aparține familiei de hormoni secretinici.
Funcția glucagonului
Glucagonul ridică în general concentrația de glucoză din sânge prin promovarea gluconeogenezei și glicogenolizei. Glucagonul scade, de asemenea, sinteza acizilor grași în țesutul adipos și în ficat. Glucagonul promovează lipoliza în aceste țesuturi, ceea ce le determină să elibereze acizi grași în circulație, unde pot fi catabolizați pentru a genera energie în țesuturi, cum ar fi mușchiul scheletic, atunci când este necesar.
Glucoza este stocată în ficat sub formă de polizaharid glicogen, care este un glucan (un polimer alcătuit din molecule de glucoză). Celulele hepatice (hepatocite) au receptori de glucagon. Când glucagonul se leagă de receptorii glucagonului, celulele hepatice transformă glicogenul în molecule individuale de glucoză și le eliberează în sânge, într-un proces cunoscut sub numele de glicogenoliză. Când stocarea glucozei se epuizează, glucagonul încurajează ficatul și rinichii să sintetizeze glucoză suplimentară prin gluconeogeneză. Glucagonul oprește glicoliza în ficat, determinând transferarea intermediarilor glicolitici la gluconeogeneză.
Glucagonul reglează, de asemenea, rata producției de glucoză prin lipoliză. Glucagonul induce lipoliza la om în condiții de suprimare a insulinei (cum ar fi diabetul zaharat tip 1).
Producția de glucagon pare să fie dependentă de sistemul nervos central prin căi care încă nu sunt definite. La animalele nevertebrate, s-a raportat că îndepărtarea ochiului afectează producția de glucagon. Excizia tulpinii oculare la raci tineri produce hiperglicemie indusă de glucagon.
Mecanismul de acțiune al glucagonului
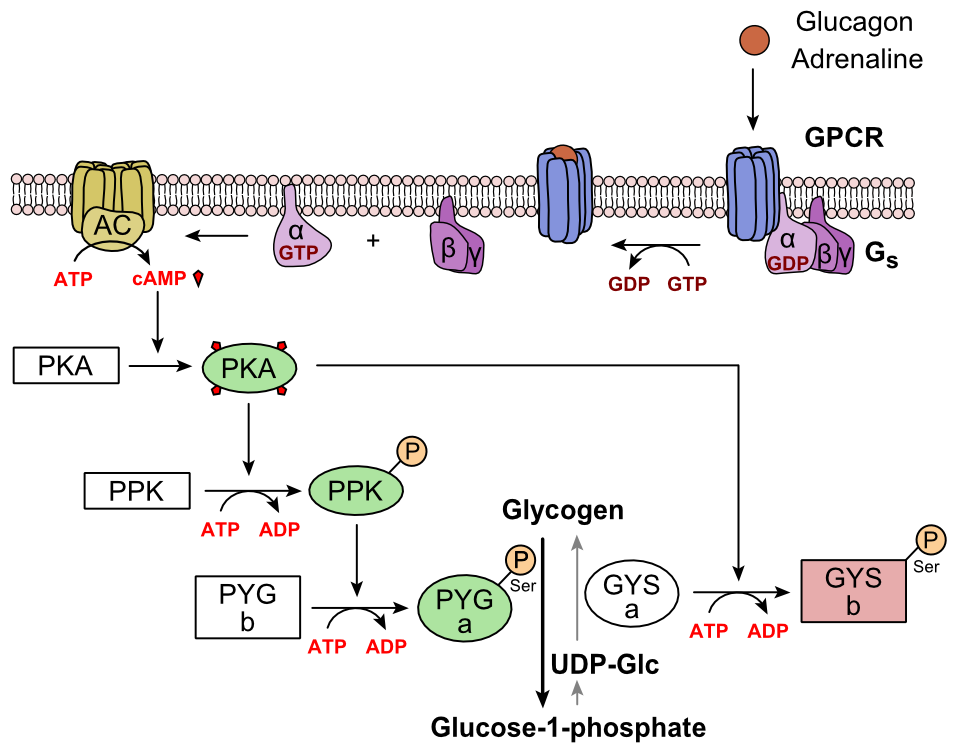
Glucagonul se leagă de receptorul glucagonului, un receptor cuplat cu proteina G, situat în membrana plasmatică a celulei. Schimbarea conformației în receptor activează proteinele G, o proteină heterotrimerică cu subunități α, β și γ. Când proteina G interacționează cu receptorul, suferă o schimbare conformațională care are ca rezultat înlocuirea moleculei PIB care a fost legată de subunitatea α cu o moleculă GTP. Această substituție are ca rezultat eliberarea subunității α din subunitățile β și γ. Subunitatea alfa activează în mod specific următoarea enzimă din cascadă, adenilat ciclaza.
Adenilat ciclaza produce adenozin monofosfat ciclic (AMP ciclic sau AMPc), care activează protein kinaza A (proteina kinază dependentă de AMPc). La rândul său, această enzimă activează fosforilaza kinază, care apoi fosforilează glicogen fosforilaza b (PYG b), transformându-l în forma activă numită fosforilază a (PYG a). Fosforilaza a este enzima responsabilă pentru eliberarea glucozei 1-fosfat din polimerii glicogenului.
Un exemplu de cale ar fi atunci când glucagonul se leagă de o proteină transmembranară. Proteinele transmembranare interacționează cu Gɑβ𝛾. Gɑ se separă de Gβ𝛾 și interacționează cu proteina transmembranară adenilil ciclaza. Adenilil ciclaza catalizează conversia ATP în AMPc. AMPc se leagă de protein kinaza A, iar complexul fosforilează fosforilaza kinază. Fosforilaza kinază fosforilată fosforilează fosforilaza. Fosforilaza fosforilată decupează unitățile de glucoză din glicogen ca 1-fosfat de glucoză.
În plus, controlul coordonat al glicolizei și gluconeogenezei în ficat este ajustat de starea de fosforilare a enzimelor care catalizează formarea unui activator puternic al glicolizei numit fructoză 2,6-bisfosfat. Enzima protein kinază A (PKA) care a fost stimulată de cascada inițiată de glucagon va fosforila și un singur reziduu de serină din lanțul polipeptidic bifuncțional care conține atât enzimele fructoză 2,6-bisfosfatază, cât și fosfofructocinaza-2. Această fosforilare covalentă inițiată de glucagon îl activează pe primul și îl inhibă pe cel din urmă. Aceasta reglează reacția care catalizează 2,6-bisfosfatul de fructoză (un activator puternic al fosfofructokinazei-1, enzima care este etapa principală de reglare a glicolizei) prin încetinirea vitezei de formare a acestuia, inhibând astfel fluxul căii glicolizei și permițând gluconeogeneza a predomina. Acest proces este reversibil în absența glucagonului (și, prin urmare, a prezenței insulinei).
Stimularea glucagonică a PKA inactivează, de asemenea, enzima glicolitică piruvat kinază în hepatocite.
Fiziologie
Producția de glucagon
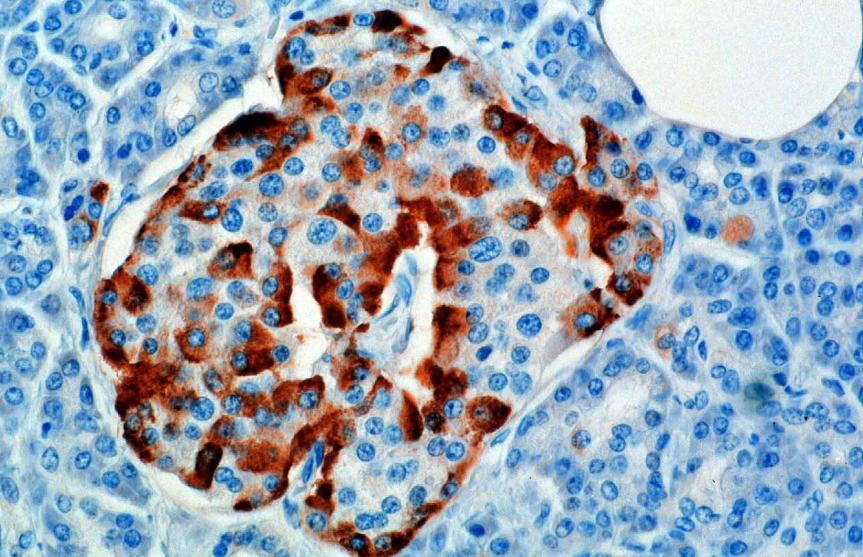
Hormonul este sintetizat și secretat din celulele alfa (celule α) ale insulelor Langerhans, care se află în porțiunea endocrină a pancreasului. Producția, care altfel este liberă, este suprimată / reglată de amilină, un hormon peptidic co-secretat cu insulină din celulele β pancreatice. Pe măsură ce nivelurile de glucoză plasmatică scad, reducerea ulterioară a secreției de amilină atenuează suprimarea celulelor α, permițând secreția de glucagon.
La rozătoare, celulele alfa sunt situate în marginea exterioară a insulei. Structura insulei umane este mult mai puțin segregată, iar celulele alfa sunt distribuite pe insulă în imediata apropiere a celulelor beta. Glucagonul este produs și de celulele alfa din stomac.
Cercetări recente au demonstrat că producția de glucagon poate avea loc și în afara pancreasului, intestinul fiind cel mai probabil loc al sintezei extrapancreatice de glucagon.
Reglarea glucagonului
Secreția de glucagon este stimulată de:
- Hipoglicemie
- Epinefrina (prin receptorii adrenergici β2, α2 și α1)
- Arginina
- Alanină (adesea din transaminarea piruvat / glutamat derivată din mușchi
- Acetilcolina
- Colecistochinina
- Polipeptidă inhibitoare gastrică
Secreția de glucagon este inhibată de:
- Somatostatină
- Amilină
- Insulină (prin GABA)
- PPARγ / heterodimerul receptorului retinoid X.
- Creșterea acizilor grași liberi și a cetoacizilor în sânge.
- Creșterea producției de uree
- Peptida-1 asemănătoare glucagonului
Structura glucagonului
Glucagonul este o polipeptidă de 29 aminoacizi. Structura sa primară la om este: NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp -Leu-Met-Asn-Thr-COOH.
Polipeptida are o masă moleculară de 3485 daltoni. Glucagonul este un hormon peptidic (nesteroid).
Glucagonul este generat din clivajul proglucagonului prin proprotein convertaza 2 în celulele α ale insulei pancreatice. În celulele L intestinale, proglucagonul este scindat de produsele alternative glicentin, GLP-1 (o incretină), IP-2 și GLP-2 (favorizează creșterea intestinală).
Patologie
Nivelurile anormal de ridicate de glucagon pot fi cauzate de tumori pancreatice, cum ar fi glucagonoma, ale căror simptome includ eritem necrolitic migrator, aminoacizi reduși și hiperglicemie. Poate să apară singură sau în contextul neoplaziei endocrine multiple de tip 1.
Glicagonul crescut este principalul factor care contribuie la cetoacidoza hiperglicemică în diabetul de tip 1 nediagnosticat sau slab tratat. Deoarece celulele beta încetează să mai funcționeze, insulina și GABA pancreatice nu mai sunt prezente pentru a suprima producția liberă de glucagon. Ca urmare, glucagonul este eliberat din celulele alfa la maximum, provocând o descompunere rapidă a glicogenului în glucoză și ketogeneza rapidă. S-a constatat că un subset de adulți cu diabet zaharat de tip 1 a durat în medie de 4 ori mai mult pentru a se apropia de cetoacidoză când li s-a administrat somatostatină (inhibă producția de glucagon) fără insulină. Inhibarea glucagonului a fost o idee populară a tratamentului pentru diabet, cu toate acestea, unii au avertizat că acest lucru va da naștere la diabet fragil la pacienții cu glucoză din sânge suficient de stabilă.
Se crede că absența celulelor alfa (și, prin urmare, a glucagonului) este una dintre principalele influențe în volatilitatea extremă a glicemiei în cadrul unei pancreatectomii totale.
Istorie
În anii 1920, Kimball și Murlin au studiat extracte pancreatice și au găsit o substanță suplimentară cu proprietăți hiperglicemice. Ei au descris glucagonul în 1923. Secvența de aminoacizi a glucagonului a fost descrisă la sfârșitul anilor 1950. O înțelegere mai completă a rolului său în fiziologie și boală nu a fost stabilită până în anii 1970, când a fost dezvoltat un test radioimunologic specific.
.













Discussion about this post