Cancerul colorectal ereditar, fără polipoză (HNPCC), numit si Sindromul Lynch, este o afecțiune genetică autosomală dominantă care este asociată cu un risc ridicat de cancer de colon, precum și alte tipuri de cancer, inclusiv cancer endometrial (al doilea cel mai frecvent), ovar, stomac, intestin subțire, tract hepatobiliar, tract urinar superior, creier și piele. Riscul crescut pentru aceste tipuri de cancer se datorează mutațiilor moștenite care afectează repararea nepotrivirii ADN-ului. Este un tip de sindrom al cancerului.
Simptomele sindromului Lynch
Risc de cancer
Riscul pe viață și vârsta medie la diagnosticarea cancerelor asociate sindromului Lynch
| Tipul de cancer | Risc pe viață (%) | Vârsta medie la diagnostic (ani) |
| Colorectal | 52-58 | 44-61 |
| Endometrial | 25-60 | 48-62 |
| Gastric | 6-13 | 56 |
| Ovarian | 4-12 | 42,5 |
În plus față de tipurile de cancer găsite în graficul de mai sus, se înțelege că sindromul Lynch contribuie, de asemenea, la un risc crescut de cancer al intestinului subțire, cancer pancreatic, cancer ureter / pelvis renal, cancer al tractului biliar, cancer al creierului și neoplasme sebacee. Riscul crescut de cancer de prostată și cancer de sân a fost, de asemenea, asociat cu sindromul Lynch, deși această relație nu este pe deplin înțeleasă.
Două treimi din cancerele de colon apar în colonul proximal, iar semnele și simptomele comune includ sânge în scaun, diaree sau constipație și scăderea greutății neintenționată. Vârsta medie a diagnosticului de cancer colorectal este de 44 de ani pentru membrii familiilor care îndeplinesc criteriile de la Amsterdam. Vârsta medie pentru diagnosticarea cancerului endometrial este de aproximativ 46 de ani. Dintre femeile cu HNPCC care au atât cancer de colon, cât și cancer endometrial, aproximativ jumătate prezintă mai întâi cancer endometrial, ceea ce face din cancerul endometrial cel mai frecvent cancer sentinel în sindromul Lynch. Cel mai frecvent simptom al cancerului endometrial este sângerarea vaginală anormală. În HNPCC, vârsta medie a diagnosticului de cancer gastric este de 56 de ani, adenocarcinomul de tip intestinal fiind cea mai frecvent raportată patologie. Cancerele ovariene asociate HNPCC au o vârstă medie de diagnostic de 42,5 ani; aproximativ 30% sunt diagnosticați înainte de vârsta de 40 de ani.
S-a constatat o variație semnificativă a ratei cancerului în funcție de mutația implicată. Până la vârsta de 75 de ani riscurile de cancer colorectal, cancer endometrial, cancer ovarian, gastrointestinal superior (gastric, duodenal, canal biliar sau pancreatic), cancere ale tractului urinar, cancer de prostată și tumori cerebrale au fost următoarele: pentru mutațiile MLH1, riscul a fost de 46%, 43%, 10%, 21%, 8%, 17% și respectiv 1%; pentru mutațiile MSH2 riscurile au fost de 57%, 17%, 10%, 25%, 32% și respectiv 5%; pentru mutațiile MSH6 riscurile au fost de 15%, 46%, 13%, 7%, 11%, 18% și respectiv 1%.
| Gene | Riscul de cancer ovarian | Riscul de cancer endometrial |
|---|---|---|
| MLH1 | 4-24% | 25-60% |
| MSH2 / EPCAM | 4-24% | 25-60% |
| MSH6 | 1-11% | 16-26% |
| PMS2 | 6% (risc combinat) | 15% |
Genetica

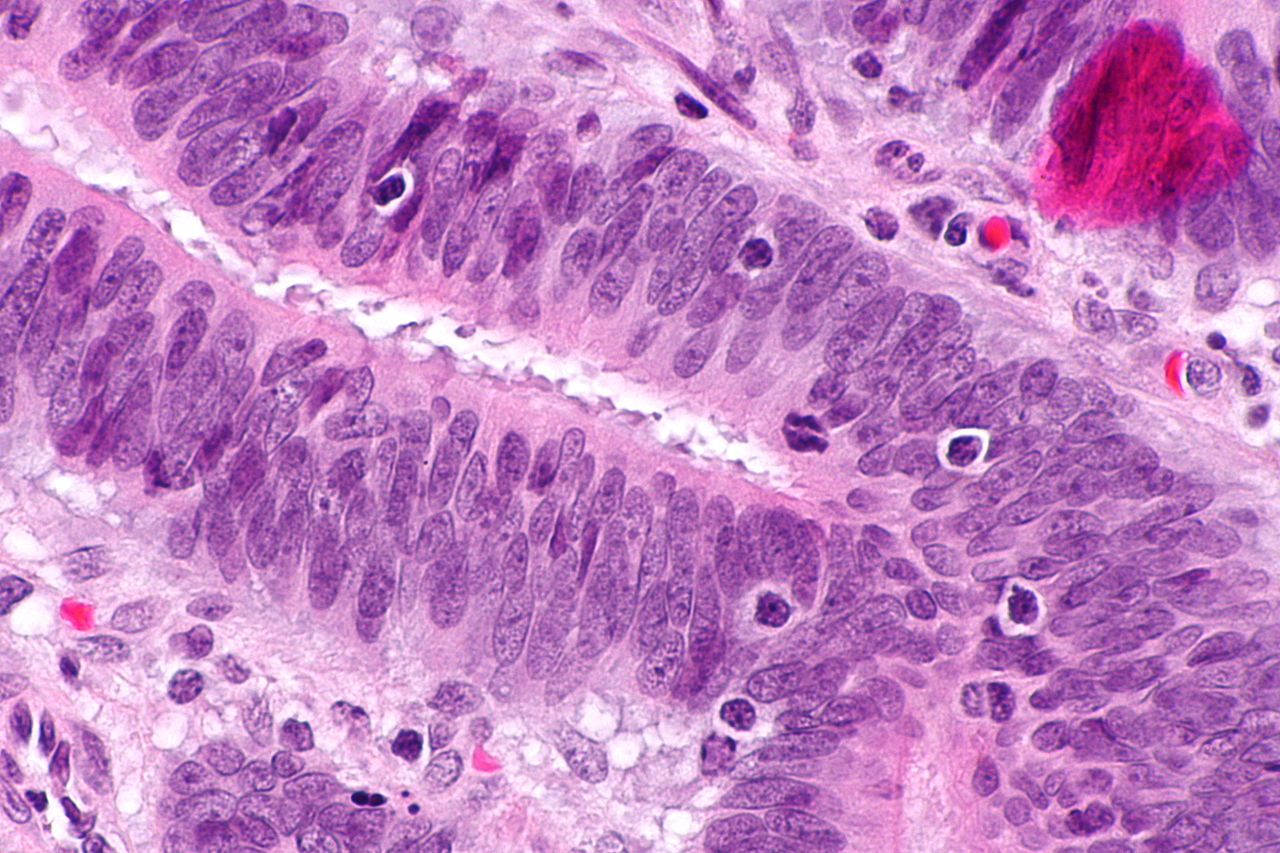
HNPCC este moștenit într-un mod autosomal dominant. Semnul distinctiv al HNPCC este repararea deficitară a nepotrivirii ADN-ului, care determină o rată ridicată de modificări ale nucleotidelor unice și instabilitate a microsateliților, cunoscută și sub numele de MSI-H (H este „înalt”). MSI este identificabil la specimenele de cancer din laboratorul de patologie. Majoritatea cazurilor au ca rezultat modificări ale lungimii repetărilor dinucleotidice ale citozinei și adeninei nucleobazelor (secvența: CACACACACACA …).
Cele 4 gene principale implicate în HNPCC codifică în mod normal funcționarea proteinelor care formează dimeri:
- Proteina MLH1 se dimerizează cu proteina PMS2 pentru a forma MutLα, care coordonează legarea altor proteine implicate în repararea nepotrivirii, cum ar fi ADN helicaza, proteina de legare a ADN-ului monocatenar (RPA) și ADN polimerazele.
- Proteina MSH2 se dimerizează cu proteina MSH6, care identifică nepotrivirile printr-un model cu clemă glisantă, o proteină pentru scanarea erorilor.
Afectarea oricărei gene pentru dimerul proteic afectează funcția proteinelor. Aceste 4 gene sunt implicate în corectarea erorilor (repararea nepotrivirii), astfel încât disfuncția genelor poate duce la incapacitatea de a remedia erorile de replicare a ADN și de a provoca HNPCC. HNPCC este cunoscut a fi asociat cu alte mutații ale genelor implicate în calea de reparare a nepotrivirii ADN-ului:
| Numele OMIM | Gene implicate în HNPCC | Frecvența mutațiilor în familiile HNPCC | Locus | Prima publicație |
|---|---|---|---|---|
| HNPCC1 (120435) | MSH2 / EPCAM | aproximativ 60% | 2p22 | Fishel 1993 |
| HNPCC2 (609310) | MLH1 | aproximativ 30% | 3p21 | Papadopoulos 1994 |
| HNPCC5 | MSH6 | 7-10% | 2p16 | Miyaki 1997 |
| HNPCC4 | PMS2 | relativ rar | 7p22 | Nicolaides 1994 |
| HNPCC3 | PMS1 | raport de caz | 2q31-q33 | Nicolaides 1994 |
| HNPCC6 | TGFBR2 | raport de caz | 3p22 | |
| HNPCC7 | MLH3 | contestat | 14q24.3 |
Majoritatea persoanelor cu HNPCC moștenesc condiția de la un părinte. Cu toate acestea, din cauza penetrării incomplete, a vârstei variabile a diagnosticului de cancer, a reducerii riscului de cancer sau a morții precoce, nu toate persoanele cu mutație genică HNPCC au un părinte care a avut cancer. Unii oameni dezvoltă HNPCC de-novo într-o nouă generație, fără a moșteni gena. Aceste persoane sunt adesea identificate numai după apariția unui cancer de colon în viața timpurie. Părinții cu HNPCC au 50% șanse să transmită mutația genetică fiecărui copil. De asemenea, este important de menționat că mutația dăunătoare a uneia dintre genele MMR nu este suficientă pentru a provoca cancer, ci că mai degrabă trebuie să apară alte mutații în alte gene supresoare tumorale.
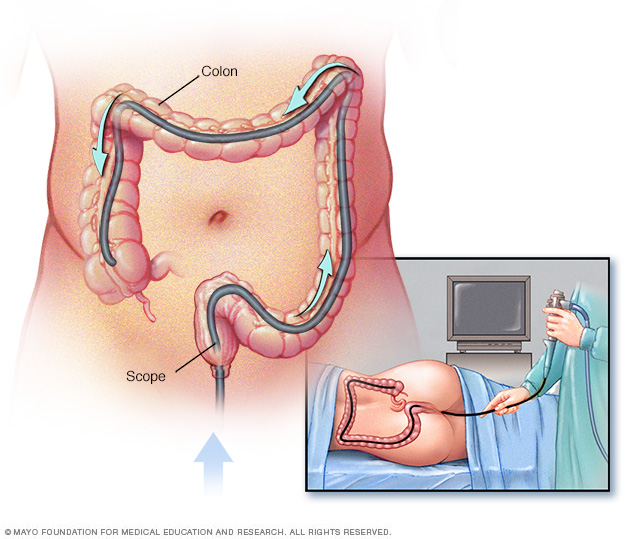
Diagnosticul sindromului Lynch
Un diagnostic de sindrom Lynch se aplică persoanelor cu mutație ADN a liniei germinale într-una dintre genele MMR (MLH1, MSH2, MSH6 și PMS2) sau gena EPCAM, identificată prin teste genetice. Candidații pentru testarea genetică a liniei germinale pot fi identificați prin criterii clinice, cum ar fi Criteriile clinice din Amsterdam și Ghidurile Bethesda, sau prin analiza tumorilor prin imunohistochimie (IHC) sau testarea instabilității microsateliților (MSI). În SUA, societățile profesionale recomandă testarea fiecărui cancer de colon pentru MSI sau IHC ca screening pentru sindromul Lynch, dar acest lucru nu se realizează întotdeauna din cauza costurilor și a limitărilor resurselor. Testarea genetică este disponibilă comercial și constă dintr-un test de sânge.
Imunohistochimie
Imunohistochimia (IHC) este o metodă care poate fi utilizată pentru a detecta expresia proteinelor anormale de reparare a nepotrivirii (MMR) în tumorile care sunt asociate cu sindromul Lynch. Deși nu este diagnosticul unui sindrom Lynch, acesta poate juca un rol în identificarea persoanelor care ar trebui să facă teste germinale. Două metode de implementare a testării IHC includ testarea bazată pe vârstă și testarea universală pentru toți oamenii. În prezent, nu există un acord generalizat cu privire la metoda de screening care ar trebui utilizată. Testarea bazată pe vârstă pentru IHC a fost sugerată parțial din cauza analizelor cost-beneficiu, în timp ce testarea universală pentru toate persoanele cu cancer colorectal asigură faptul că persoanele cu sindrom Lynch nu sunt ratate. Pentru a aborda costurile, cercetătorii încearcă să prezică MSI sau IHC direct din modul în care arată tumoarea la microscop, fără a face nicio testare moleculară.
Instabilitate microsatelit
Mutațiile din sistemele de reparare a nepotrivirii ADN pot duce la dificultăți de transmitere a regiunilor din ADN care conțin modele repetate de două sau trei nucleotide (microsateliți), cunoscute altfel ca instabilitate microsatelitică (MSI). MSI este identificat prin extracția ADN atât dintr-o probă de țesut tumoral, cât și dintr-o probă normală de țesut, urmată de analiza PCR a regiunilor de microsateliți. Analiza MSI poate fi utilizată pentru a identifica persoanele care pot avea sindrom Lynch și pentru a le direcționa spre teste ulterioare.
Clasificare
Trei grupuri majore de cancere MSI-H (instabilitate microsatelită – MSI) pot fi recunoscute după criterii histopatologice:
- cancere de dreapta slab diferențiate
- cancerele mucinoase din partea dreaptă
- adenocarcinoame în orice locație care prezintă orice nivel măsurabil de limfocit intraepitelial (TIL)
Criteriile histopatologice nu sunt suficient de sensibile pentru a detecta MSI din histologie, dar cercetătorii încearcă să utilizeze inteligența artificială pentru a prezice MSI din histologie.
În plus, HNPCC poate fi împărțit în sindromul Lynch I (cancer de colon familial) și sindromul Lynch II (HNPCC asociat cu alte tipuri de cancer ale tractului gastro-intestinal sau ale sistemului reproductiv).
Prevenirea
Test de screening
Consilierea genetică și testarea genetică sunt recomandate familiilor care îndeplinesc criteriile de la Amsterdam, de preferință înainte de apariția cancerului de colon.
Cancer de colon
Colonoscopiile sunt recomandate ca metodă preventivă de supraveghere pentru persoanele cu sindrom Lynch sau gene asociate LS. Mai exact, se recomandă ca colonoscopiile să înceapă la vârsta de 20-25 de ani pentru purtătorii de mutații MLH1 și MSH2 și 35 de ani pentru purtătorii de mutații MSH6 și PMS2. Supravegherea colonoscopică trebuie apoi efectuată la un interval de 1-2 ani pentru pacienții cu sindrom Lynch.
Cancer endometrial / ovarian
O ecografie transvaginală cu sau fără biopsie endometrială este recomandată anual pentru screeningul cancerului ovarian și endometrial. Pentru femeile cu sindrom Lynch, un test de sânge anual CA-125 poate fi utilizat pentru a depista cancerul ovarian, totuși există date limitate cu privire la eficacitatea acestui test în reducerea mortalității.
Alte tipuri de cancer
Există, de asemenea, strategii pentru depistarea precoce a altor tipuri de cancer sau reducerea șanselor de a le dezvolta, pe care persoanele cu sindrom Lynch le pot discuta cu medicul lor, însă eficacitatea lor nu este clară. Aceste opțiuni includ:
- Endoscopii superioare pentru detectarea cancerului de stomac și intestinului subțire la fiecare 3-5 ani, începând cu vârsta de 30 de ani cel mai devreme (de preferință într-un cadru de cercetare)
- Analiza anuală a urinei pentru detectarea cancerului de vezică urinară, începând cu vârsta de 30 de ani cel mai devreme (de preferință într-un cadru de cercetare)
- Examene fizice și neurologice anuale pentru depistarea cancerului în sistemul nervos central (creier sau măduva spinării), începând cu vârsta de 25 de ani
Criteriile Amsterdam
Următoarele sunt criteriile de la Amsterdam în identificarea candidaților cu risc ridicat pentru testarea genetică moleculară:
Criteriile Amsterdam I (toate punctele trebuie să fie îndeplinite):
- Trei sau mai mulți membri ai familiei cu un diagnostic confirmat de cancer colorectal, dintre care unul este rudă de gradul I (părinte, copil, frate) dintre ceilalți doi
- Două generații succesive afectate
- Unul sau mai multe tipuri de cancer de colon diagnosticate cu vârsta sub 50 de ani
- A fost exclusă polipoză adenomatoasă familială (FAP)
Criteriile Amsterdam II au fost dezvoltate în 1999 și au îmbunătățit sensibilitatea diagnosticului pentru sindromul Lynch prin includerea cancerelor endometrului, intestinului subțire, ureterului și pelvisului renal.
Criteriile Amsterdam II (toate punctele glonț trebuie îndeplinite):
- Trei sau mai mulți membri ai familiei cu cancer legate de HNPCC, dintre care unul este o rudă de gradul I a celorlalte două
- Două generații succesive afectate
- Unul sau mai multe dintre cancerele legate de HNPCC diagnosticate cu vârsta sub 50 de ani
- A fost exclusă polipoză adenomatoasă familială (FAP)
Interventie chirurgicala
Histerectomia profilactică și salpingo-ooforectomia (îndepărtarea uterului, a trompelor uterine și a ovarelor pentru a preveni dezvoltarea cancerului) pot fi efectuate înainte de apariția cancerului ovarian sau endometrial.
Tratamentul sindromului Lynch
Chirurgia rămâne terapia de primă linie pentru HNPCC. Pacienții cu sindrom Lynch care dezvoltă cancer colorectal pot fi tratați fie cu o colectomie parțială, fie cu colectomie totală cu anastomoză ileorectală. Datorită riscului crescut de cancer colorectal în urma colectomiei parțiale și a calității vieții similare după ambele intervenții chirurgicale, o colectomie totală poate fi un tratament preferat pentru HNPCC, în special la pacienții mai tineri.
Există o controversă în curs de desfășurare cu privire la beneficiile terapiilor adjuvante pe bază de 5-fluorouracil pentru tumorile colorectale legate de HNPCC, în special cele din stadiile I și II.
- Terapia cu anticorpi anti-PD-1 poate fi eficientă.
Blocarea punctului de control cu terapia anti-PD-1 este acum preferată terapie de primă linie pentru microsatelit avansat – Instabilitate – Cancer colorectal ridicat.
.
















Discussion about this post