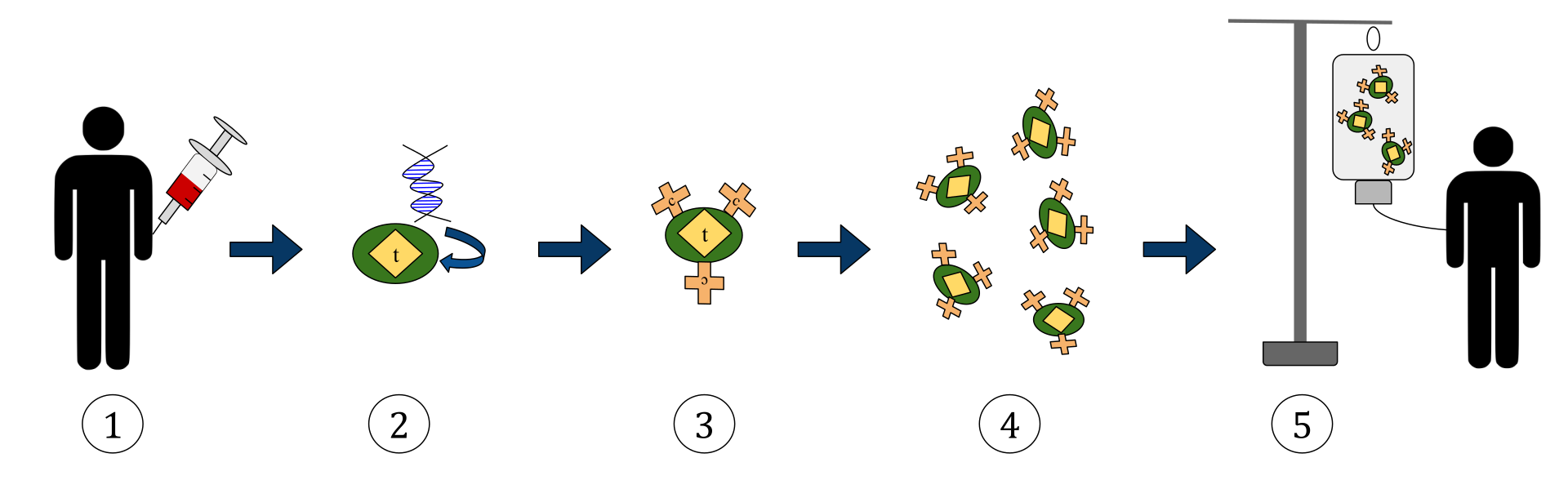
Diagrama de mai sus reprezintă procesul terapiei cu celule T a receptorilor antigenici himerici (CAR). Aceasta este o metodă de imunoterapie, care este o practică în creștere în tratamentul cancerului. Rezultatul final ar trebui să fie o producție de celule T echipate care pot recunoaște și combate celulele canceroase infectate din organism.
1. Celulele T (reprezentate de obiecte etichetate ca „t”) sunt îndepărtate din sângele pacientului.
2. Apoi, într-un cadru de laborator, gena care codifică receptorii antigenului specifici este încorporată în celulele T.
3. Producând astfel receptorii CAR (etichetați ca c) pe suprafața celulelor.
4. Celulele T nou modificate sunt apoi recoltate și crescute în laborator.
5. După o anumită perioadă de timp, celulele T proiectate sunt perfuzate înapoi în pacient.
Celulele T ale receptorului antigenului himeric (de asemenea cunoscut ca si Celule T CAR) sunt celule T care au fost proiectate genetic pentru a produce un receptor artificial de celule T pentru utilizare în imunoterapie.
Receptorii antigenilor chimerici (AUTO, de asemenea cunoscut ca si imunoreceptori himerici, receptori himerici ai celulelor T, sau receptori artificiali ai celulelor T) sunt proteine receptor care au fost proiectate pentru a da celulelor T noua capacitate de a viza o proteină specifică. Receptorii sunt himerici deoarece combină atât funcția de legare a antigenului, cât și funcțiile de activare a celulelor T într-un singur receptor.
Terapia cu celule CAR-T utilizează celule T proiectate cu CAR pentru terapia cancerului. Premisa imunoterapiei CAR-T este de a modifica celulele T pentru a recunoaște celulele canceroase pentru a le viza și distruge mai eficient. Oamenii de știință recoltează celule T de la oameni, le modifică genetic, apoi perfuzează celulele CAR-T rezultate pacienților pentru a le ataca tumorile. Celulele CAR-T pot fi derivate fie din celule T din propriul sânge al pacientului (autolog), fie derivate din celulele T ale unui alt donator sănătos (alogen). Odată izolate de o persoană, aceste celule T sunt modificate genetic pentru a exprima un CAR specific, care le programează pentru a viza un antigen care este prezent pe suprafața tumorilor. Pentru siguranță, celulele CAR-T sunt proiectate pentru a fi specifice unui antigen exprimat pe o tumoare care nu este exprimată pe celule sănătoase.
După ce celulele CAR-T sunt perfuzate unui pacient, ele acționează ca un „medicament viu” împotriva celulelor canceroase. Când intră în contact cu antigenul țintit pe o celulă, celulele CAR-T se leagă de acesta și devin activate, apoi continuă să prolifereze și să devină citotoxice. Celulele CAR-T distrug celulele prin mai multe mecanisme, inclusiv proliferarea stimulată extinsă a celulelor, crescând gradul în care sunt toxice pentru alte celule vii (citotoxicitate) și provocând secreția crescută a factorilor care pot afecta alte celule, cum ar fi citokinele, interleukinele și factorii de creștere.
Producerea de celule CAR-T

Primul pas în producția de celule CAR-T este izolarea celulelor T din sângele uman. Celulele CAR-T pot fi fabricate fie din propriul sânge al pacientului, cunoscut sub numele de tratament autolog, fie din sângele unui donator sănătos, cunoscut sub numele de tratament alogen. Procesul de fabricație este același în ambele cazuri; doar alegerea donatorului inițial de sânge este diferită.
În primul rând, leucocitele sunt izolate folosind un separator de celule sanguine într-un proces cunoscut sub numele de afereza leucocitelor. Celulele mononucleare din sângele periferic (PBMC) sunt apoi separate și colectate. Produsele aferente ale leucocitelor sunt apoi transferate la un centru de procesare a celulelor. În centrul de procesare a celulelor, celulele T specifice sunt stimulate astfel încât acestea să prolifereze în mod activ și să se extindă la un număr mare. Pentru a stimula expansiunea lor, celulele T sunt de obicei tratate cu citokine interleukina 2 (IL-2) și anticorpi anti-CD3.
Celulele T expandate sunt purificate și apoi transduse cu o genă care codifică CAR-ul proiectat printr-un vector retroviral, de obicei fie un gammaretrovirus integrant (RV), fie un vector lentiviral (LV). Acești vectori sunt foarte siguri în timpurile moderne datorită unei ștergeri parțiale a regiunii U3. Noul instrument de editare a genei CRISPR / Cas9 a fost folosit recent în locul vectorilor retrovirali pentru a integra gena CAR în situri specifice din genom.
Pacientul este supus chimioterapiei limfodepletiei înainte de introducerea celulelor CAR-T proiectate. Epuizarea numărului de leucocite circulante la pacient reglează numărul de citokine care sunt produse și reduce concurența pentru resurse, ceea ce ajută la promovarea extinderii celulelor CAR-T proiectate.
Aplicații clinice
În martie 2019, au existat în jur de 364 de studii clinice aflate în desfășurare la nivel global, care implică celule CAR-T. Majoritatea acestor studii vizează cancerele de sânge: terapiile CAR-T reprezintă mai mult de jumătate din toate studiile pentru malignități hematologice. CD19 continuă să fie cea mai populară țintă antigenică, urmată de BCMA (exprimată în mod obișnuit în mielom multiplu). În 2016, studiile au început să exploreze viabilitatea altor antigeni, cum ar fi CD20. Studiile pentru tumorile solide sunt mai puțin dominate de CAR-T, cu aproximativ jumătate din studiile bazate pe terapia celulară care implică alte platforme, cum ar fi celulele NK.
Cancer
Celulele T sunt proiectate genetic pentru a exprima receptori antigenici himerici direcționați în mod specific către antigene pe celulele tumorale ale pacientului, apoi sunt perfuzate în pacient unde atacă și ucid celulele canceroase. Transferul adoptiv al celulelor T care exprimă CAR este un tratament terapeutic anticancer, deoarece Celulele T modificate CAR pot fi proiectate pentru a viza practic orice antigen asociat tumorii.
Cercetarea timpurie a celulelor CAR-T s-a concentrat asupra cancerelor de sânge. Primele tratamente aprobate utilizează CAR care vizează antigenul CD19, prezent în cancerele derivate din celulele B, cum ar fi leucemia limfoblastică acută (ALL) și limfomul difuz cu celule B mari (DLBCL). Există, de asemenea, eforturi pentru a ingineri CAR care vizează mulți alți antigeni ai cancerului de sânge, inclusiv CD30 în limfomul Hodgkin refractar; CD33, CD123 și FLT3 în leucemia mieloidă acută (LMA); și BCMA în mielom multiplu.
Tumorile solide au prezentat o țintă mai dificilă. Identificarea antigenilor buni a fost o provocare: astfel de antigeni trebuie să fie foarte exprimați pe majoritatea celulelor canceroase, dar absenți în mare parte pe țesuturile normale. De asemenea, celulele CAR-T nu sunt traficate eficient în centrul maselor tumorale solide, iar microambientul tumorii ostile suprimă activitatea celulelor T.
Boala autoimuna
În timp ce majoritatea studiilor privind celulele T CAR se concentrează pe crearea unei celule T CAR care poate eradica o anumită populație de celule (de exemplu, celulele T CAR care vizează celulele limfomului), există alte utilizări potențiale pentru această tehnologie. Celulele T pot proteja, de asemenea, autoantigenele de reacțiile autoimune. O celulă T reglatoare echipată cu un CAR ar putea avea potențialul de a conferi toleranță unui antigen specific, ceva care ar putea fi utilizat în transplantul de organe sau în bolile reumatice, cum ar fi lupusul.
Satefy
Există efecte secundare grave care rezultă din introducerea celulelor CAR-T în organism, inclusiv sindromul de eliberare a citokinelor și toxicitatea neurologică. Deoarece este un tratament relativ nou, există puține date despre efectele pe termen lung ale terapiei cu celule CAR-T. Există încă îngrijorări cu privire la supraviețuirea pe termen lung a pacienților, precum și la complicațiile sarcinii la pacienții de sex feminin tratați cu celule CAR-T. Anafilaxia este un efect secundar așteptat, deoarece CAR este produs cu un anticorp monoclonal străin și, ca urmare, provoacă un răspuns imun.
Recunoașterea on-target / off-tumor apare atunci când celula CAR-T recunoaște antigenul corect, dar antigenul este exprimat pe țesut sănătos, nepatogen. Acest lucru are ca rezultat celulele CAR-T care atacă țesutul non-tumoral, cum ar fi celulele B sănătoase care exprimă CD19. Severitatea acestui efect advers poate varia de la aplazia celulelor B, care poate fi tratată cu perfuzii de susținere, până la toxicitatea extremă care duce la deces.
Există, de asemenea, posibilitatea puțin probabilă ca celulele CAR-T proiectate să devină ele însele transformate în celule canceroase prin mutageneză inserțională, datorită vectorului viral care introduce gena CAR într-un supresor tumoral sau oncogen în genomul celulei T gazdă. Unii vectori retrovirali (RV) prezintă un risc mai mic decât vectorii lentivirali (LV). Cu toate acestea, ambele au potențialul de a fi oncogene. Analiza secvențierii genomice a siturilor de inserție CAR în celulele T a fost stabilită pentru o mai bună înțelegere a funcției celulelor T CAR și a persistenței in vivo.
Sindromul de eliberare de citokine
Cea mai frecventă problemă după tratamentul cu celule CAR-T este sindromul de eliberare a citokinelor (CRS), o afecțiune în care sistemul imunitar este activat și eliberează un număr crescut de citokine inflamatorii. Manifestarea clinică a acestui sindrom seamănă cu sepsisul cu febră mare, oboseală, mialgie, greață, scurgeri capilare, tahicardie și alte disfuncții cardiace, insuficiență hepatică și insuficiență renală. CRS apare la aproape toți pacienții tratați cu terapie cu celule CAR-T; de fapt, prezența CRS este un marker de diagnostic care indică faptul că celulele CAR-T funcționează așa cum sunt destinate distrugerii celulelor canceroase. Rețineți, totuși, că un grad mai ridicat de severitate CRS nu se corelează cu un răspuns crescut la tratament, ci mai degrabă cu o sarcină mai mare a bolii.
Neurotoxicitate asociată celulei efectoare imune
Toxicitatea neurologică este, de asemenea, adesea asociată cu tratamentul cu celule CAR-T. Mecanismul de bază este slab înțeles și poate fi sau nu legat de CRS. Manifestările clinice includ delirul, pierderea parțială a capacității de a vorbi coerent în timp ce încă mai are capacitatea de a interpreta limbajul (afazie expresivă), vigilența scăzută (obtundare) și convulsiile. În timpul unor studii clinice au apărut decese cauzate de neurotoxicitate. Principala cauză de deces din cauza neurotoxicității este edemul cerebral. Într-un studiu realizat de Juno Therapeutics, Inc., cinci pacienți înscriși în studiu au murit ca urmare a edemului cerebral. Doi dintre pacienți au fost tratați numai cu ciclofosfamidă și restul de trei au fost tratați cu o combinație de ciclofosfamidă și fludarabină. Într-un alt studiu clinic sponsorizat de Fred Hutchinson Cancer Research Center, a fost raportat un caz de toxicitate neurologică ireversibilă și fatală la 122 de zile după administrarea celulelor CAR-T.
.














Discussion about this post